研究揭示防止乳腺癌发生的三道防线
英国剑桥大学、荷兰癌症研究所与比利时VIE-KU Leuven癌生物学研究中心的研究者合作,揭示了乳腺组织内防止发生致癌突变细胞形成肿瘤的三道防线:第一道防线是乳腺导管内具有自我更新能力的乳腺干细胞,它们产生的绝大多数后代寿命都只有几个月,因此即便是携带致癌突变的细胞也不容易长期存活;第二道防线则是受雌激素调节的乳腺组织局部重塑,这会全面且随机性地随着月经周期,清除大多数突变细胞克隆;最后一道防线则是乳腺导管的特殊形态,会限制细胞克隆的扩张空间。(Nature. 2024, 633: 198-206.)
研究者敲除了Confetti小鼠的Brca1和Trp53基因(使绝大多数Confetti标记细胞的Brca1或Trp53基因发生重组),在饲养200~250天后,小鼠乳腺长出了可明显被触及的肿瘤,符合两种基因突变时导致乳腺癌风险的升高。
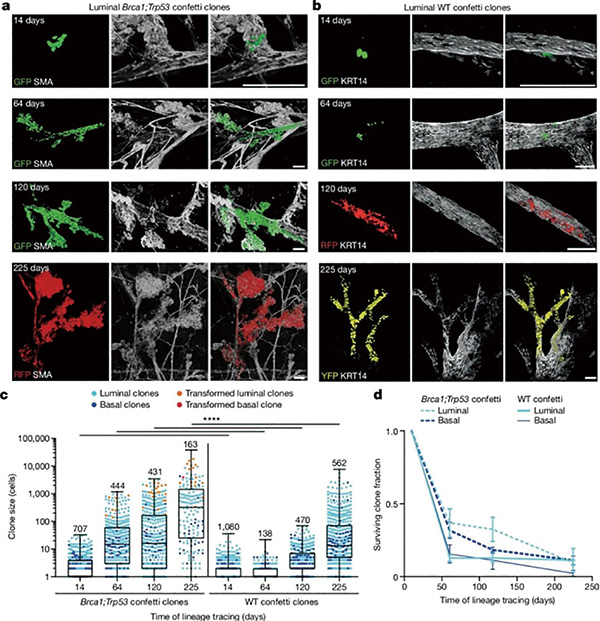
乳腺导管系统各处还存在许多发生Brca1或Trp53重组,却并未癌变的细胞克隆,而作为对照的Brca1/Trp53野生型细胞克隆,也按同样的模式在导管系统各处散布。更简洁地说,不管是否有Brca1或Trp53突变,细胞克隆都能区域定植(field clonalization)。
研究者推测导致区域定植的驱动力,很可能是其中一部分细胞克隆源自乳腺干细胞(MaSC),它们可向乳腺干细胞产生后代所在的位置播散,而Brca1/Trp53野生型的“普通”细胞克隆,则会由于缺乏自我更新能力而逐步消亡;对乳腺内细胞命运的分析也确实如此,研究者同时发现,乳腺干细胞产生的后代细胞,有80%~90%寿命仅有几个月。
由此,乳腺防癌的第一道防线就浮现了:乳腺干细胞们产生的后代大多短命,所以即便携带致癌突变,细胞也不容易长期存活,只有少数细胞能存活并在乳腺导管内广泛扩散。但研究者同时注意到,突变状态相同细胞克隆的大小各不相同,更准确地说,各个细胞克隆严格遵循了对数正态分布(Log-normal distribution),即大多数克隆体积小,少数则能增大数百倍。
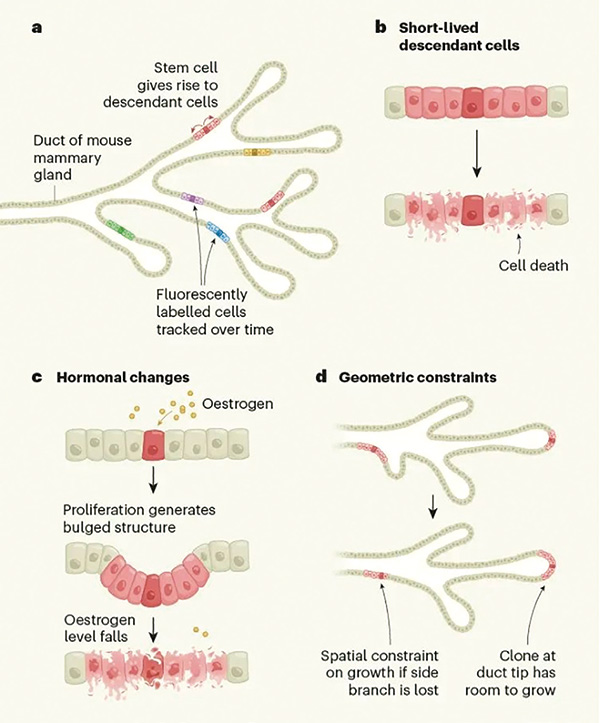
研究者们推测这可能与乳腺干细胞在月经周期时被雌激素调控有关(导致乳腺导管伸展,上皮增生等生理改变),并在试验中证实月经周期是导致乳腺干细胞更替,即旧细胞死亡、新细胞出现的动力,而也正是由于乳腺干细胞更替和组织的重塑,乳腺内至少一半的细胞克隆会在月经周期内消失,这种清除效应就是第二道防线,但少数狡猾的克隆不仅能存活下来,还会借着月经周期干细胞增殖的机会加速生长,所以体积才非常大。
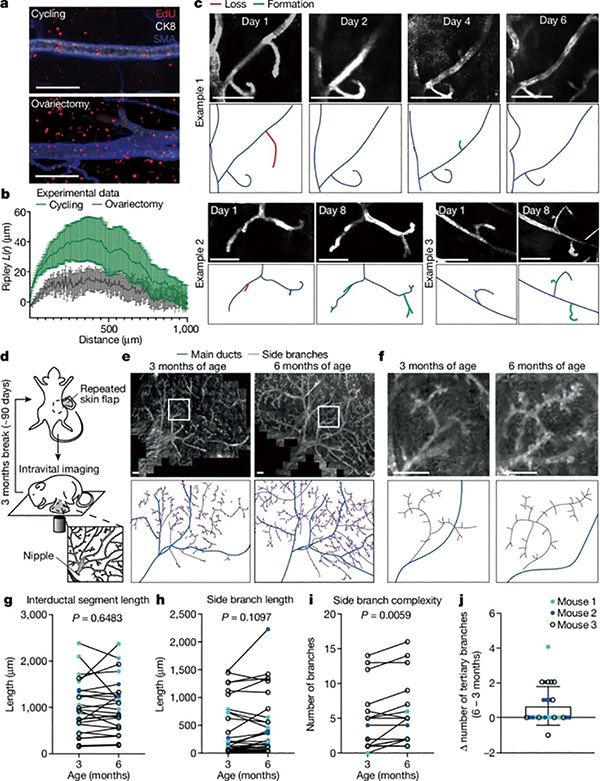
最后一道防线,Brca1/Trp53突变型和野生型细胞克隆,都会按相同模式在乳腺导管内分布,这是因为乳腺导管的线性形态对细胞生长在空间维度进行了限制,且携带致癌突变的细胞还要与周围细胞竞争,使细胞克隆的扩张空间有限;只有少数在导管末端的细胞相对不受限制,也更容易形成体积较大的肿瘤。
该研究揭示了乳腺癌发生和正常组织防癌相关的奥秘,不过人类乳腺相比小鼠要复杂得多,未来还需要开展转化研究,来验证研究结论是否能在人体内复现。
(编译 崔奕贝)


