AACR年会热点研究撷萃
美国癌症研究协会(AACR)成立于1907年,是世界上创立最早、规模最大的专注肿瘤研究的科学组织,目前拥有超过39000名会员。AACR年会是世界上规模最大的肿瘤领域学术盛会之一,每年都会吸引全球60多个国家20000余名肿瘤领域专业人士出席会议。今年AACR年会上有哪些热点研究值得关注,一起来看看吧。
KEYNOTE-189研究:EGFR或ALK突变阴性的转移性NSCLC
Pembrolizumab联合化疗一线治疗生存获益显著
美国纽约大学Gandhi报告了KEYNOTE-189研究结果,用于EGFR突变或ALK突变阴性、转移性非鳞非小细胞肺癌(NSCLC)患者一线治疗,铂类-培美曲塞标准方案联合Pembrolizumab对比单纯化疗可显著延长总生存(OS)及无进展生存(PFS)。(N Engl J Med. 2018年4月16在线版 doi: 10.1056/NEJMoa1801005; 2018年AACR大会. 摘要号CT075)
基于Ⅱ期研究KEYNOTE-021研究结果,Pembrolizumab联合培美曲塞+卡铂化疗已获美国FDA批准用于这类患者的一线治疗。KEYNOTE-189研究结果显示,Pembrolizumab联合化疗用于非鳞转移性NSCLC患者一线治疗,与标准化疗+安慰剂相比,可降低48%的疾病进展风险。
该项随机双盲Ⅲ期临床研究共入组616例初治的转移性非鳞NSCLC患者,均无EGFR或ALK敏感基因突变,按照2︰1的比例随机分组,分别接受Pembrolizumab联合化疗或化疗联合安慰剂治疗。对照组患者治疗过程中若出现疾病进展,可交叉至Pembrolizumab单药治疗。主要研究终点为OS和PFS。

结果显示,中位随访10.5个月,预计12个月OS率在Pembrolizumab组为69.2%,在对照组为49.4%(HR=0.49,95%CI 0.38~0.64,P<0.001),中位OS分别为未达到和11.3个月。中位PFS在Pembrolizumab组为8.8个月,对照组为4.9个月(HR=0.52,95%CI 0.43~0.64,P<0.001)。Pembrolizumab组和对照组客观缓解率分别为47.6%和18.9%。所有PD-L1不同表达水平亚组患者中,Pembrolizumab组生存及缓解率均有显著优势。3级及以上不良反应在联合Pembrolizumab组为67.2%,在联合安慰剂组为65.8%。
研究者指出,对照组患者交叉率达50%的基础上仍表现出显著的生存获益,提示早期优先选择免疫治疗联合化疗可能比病情进展后再使用PD-1/PD-L1抑制剂更好。联合Pembrolizumab组除了急性肾损伤发生率较高外(试验组5.2%,对照组0.5%),其他不良反应均在预期范围内。该研究的局限性在于未进行PD-L1高表达人群Pembrolizumab单药与Pembrolizumab联合化疗的疗效对比。研究者表示,PD-L1肿瘤比例评分(TPS)<1%和1%~49%的患者,应接受Pembrolizumab联合化疗;TPS≥50%的患者可选择Pembrolizumab单药或Pembrolizumab联合化疗,可根据临床情况和毒性来决定。
(编译 邱娇娇 审校 黄海力)
Checkmate-227研究:高肿瘤突变负荷肺癌患者
Nivolumab联合Ipilimumab奠定一线治疗地位
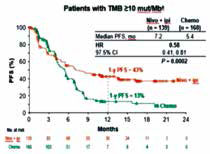
美国纪念斯隆凯特琳癌症中心Hellmann等报告的Checkmate-227研究亚组分析显示,高肿瘤突变负荷(TMB)的非小细胞肺癌(NSCLC)患者,无论PD-L1表达水平如何,一线Nivolumab联合Ipilimumab较单纯化疗均有显著无进展生存期(PFS)获益及客观缓解率(ORR)优势,TMB可作为新型免疫疗法优势人群筛选标志物。(N Engl J Med. 2018年4月16在线版 doi: 10.1056/NEJMoa1801946; 2018年AACR大会. 摘要号CT077)
本试验进一步验证了Nivolumab联合Ipilimumab治疗NSCLC的获益,及TMB作为获益人群筛选生物标志物的作用。TMB反映了肿瘤细胞所携带的体细胞突变总数,高TMB的肿瘤细胞一般具有较高的新抗原水平,被认为可帮助免疫系统识别肿瘤并刺激抗肿瘤T细胞的活化增生和抗肿瘤效应。TMB可帮助预测患者对免疫疗法的反应,CheckMate - 568研究显示高TMB患者的ORR较高。
研究者从Checkmate-227研究中选取了近300例高TMB且无EGFR和ALK基因突变的晚期NSCLC患者,分析这些高TMB患者中联合免疫疗法与化疗的疗效。用FoundationOne CDx检测TMB水平。139例患者接受Nivolumab联合Ipilimumab治疗,160例接受化疗。
结果显示,高TMB患者中,Nivolumab联合Ipilimumab对比单纯化疗显著延长PFS,1年PFS率分别为42.6%和13.2%,中位PFS分别为7.2个月和5.5个月,疾病进展或死亡风险比为0.58(97.5%CI 0.41~0.81,P<0.001)。
联合免疫治疗组和化疗组的客观缓解率分别为45.3%和26.9%,1年仍持续缓解患者比例分别为68%和25%。总生存结果尚未公布,目前总生存率分别为67%和58%。Nivolumab联合Ipilimumab对比单纯化疗在不同PD-L1表达水平亚组均有一致的获益。Nivolumab联合Ipilimumab组3~4级治疗相关不良反应发生率为31.2%,单纯化疗组为36.1%。
研究者表示,这一能改变临床实践的研究奠定了高TMB的NSCLC患者中Nivolumab联合Ipilimumab一线治疗的地位,同时证实TMB是初治晚期NSCLC患者应用双免疫联合治疗的重要的可靠的独立生物标志物,初诊患者应接受TMB检测。
(编译 邱娇娇 审校 黄海力)
Nivolumab新辅助治疗研究引关注
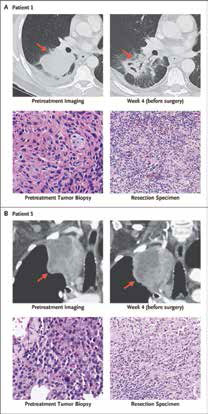
美国Sidney Kimmel综合癌症中心Forde等报告,Nivolumab新辅助治疗非小细胞肺癌(NSCLC)的不良反应小,不影响手术,在45%的手术患者中诱导了显著病理学缓解,样本中可检出肿瘤细胞占比不到10%。(N Engl J Med. 2018年4月16在线版 doi: 10.1056/NEJMoa1716078; 2018年AACR大会. 摘要号CT079)
研究显示,肿瘤突变负荷可预测PD-1单抗能否诱导病理缓解。治疗可以诱导外周血中突变相关的新抗原特异性T细胞克隆数目的扩增。既往研究证实PD-1单抗可延长晚期NSCLC患者生存,但其在可切除NSCLC中尚未有研究,该领域近10年来都未取得进展。
该研究入组未经治疗并且可手术切除的早期(Ⅰ、Ⅱ或ⅢA期)NCSLC成人患者,术前接受两次PD-1单抗Nivolumab治疗。Nivolumab用法为3 mg/kg,静脉注射,每2周一次,首次给药后4周手术。主要研究终点为安全性及可行性。
结果显示,Nivolumab新辅助治疗的不良反应小,并且不影响手术治疗。21例肿瘤切除患者中,有20例为完全切除,45%(9/20例)的患者获得了显著病理缓解,病理缓解与治疗前肿瘤突变负荷呈显著相关性,PD-L1表达不影响Nivolumab治疗价值。
为期12个月的随访内,20例完全切除肿瘤的患者中有16例未出现复发,18个月的无进展生存率达73%。Nivolumab术前使用也只引起了5例患者轻微治疗副作用,并未延误手术时机。
研究者对该研究结果持谨慎态度,认为该研究为单臂研究,样本量小,随访时间还相对较短,不能将该研究结果与既往研究结果比较。但业界已经对该研究初步结果倍感兴奋,有专家认为该研究是突破性的,彰显了挖掘免疫疗法在不同分期肿瘤中应用的重要性,会激发人们对不同实体瘤新辅助临床研究的兴趣。
(编译 邱娇娇 审校 黄海力)
吴一龙教授口头报告CheckMate-078研究

会上,广东省人民医院吴一龙教授报告了CheckMate-078研究结果,这是中国专家第一次在AACR会议上进行口头报告。该研究中,中国患者占到九成,在铂类化疗失败的晚期肺癌患者中,对比了Nivolumab与标准化疗药物多西他赛的疗效差异。
结果显示,在研究的各主要评价指标上,Nivolumab都完胜化疗方案。与化疗组相比,Nivolumab将患者中位总生存期从9.6个月延长到12个月,死亡风险相对降低32%,部分患者生存期超过18个月。
Nivolumab组客观缓解率显著高于标准治疗组(17% vs. 4%),中位持续缓解时间化疗组仅为5.3个月,Nivolumab组尚未达到,疾病进展风险降低23%。Nivolumab耐受性优于化疗,治疗相关3/4级不良反应发生率较低(10% vs. 47%),肺腺癌和其他类型非小细胞患者中,Nivolumab治疗有一致获益。
研究者说
吴一龙教授指出,CheckMate-078研究是第一项针对东亚人群特别以中国人为主的免疫检查点抑制剂研究。针对国人特点,第一次将EGFR突变阳性和ALK融合基因阳性患者排除在外。这对于整个东亚地区意义重大。40%的东亚肺癌患者驱动基因阳性,免疫检查点抑制剂在此类患者二线治疗中疗效欠佳。第一次在二线治疗中前瞻性地将PD-L1表达作为分层因素,可保证组间平衡。研究中50%的患者为PD-L1阳性,两组间无偏倚出现。既往所有前瞻性Ⅲ期临床研究都将PD-L1表达作回顾性分析。该研究结果显示鳞癌患者的疗效较好,中位OS达到12个月,提示鳞癌可能是免疫治疗的优势人群。同时也观察到非鳞癌患者的获益与全球研究一致。中国患者中吸烟多及性别与组织学类型有关,吸烟患者中腺癌较少。鳞癌中可能存在PD-L1高表达、高肿瘤突变负荷(TMB)。
CheckMate-078研究与CheckMate-017、CheckMate-057研究的结果非常一致,免疫检查点抑制剂完胜化疗,未来国人二线治疗完全有可能做到无化疗(chemo-free),无化疗未来很可能成为标准治疗。随着该研究结果公布,Nivolumab很可能今年第三季度在我国获批上市,二线治疗有可能可以推荐免疫检查点抑制剂治疗,化疗退居三四线。
(编译 张蓉)
IMpower150研究:初治晚期非鳞NSCLC
Atezolizumab联合治疗有无进展生存获益
会上公布的IMpower150研究结果显示,治疗初治晚期非鳞非小细胞肺癌(NSCLC)患者,PD-L1抑制剂Atezolizumab联合化疗和血管抑制剂治疗可显著改善无进展生存,无论PD-L1表达水平如何,都有这种获益。该研究还在进行。(摘要号 CT076)
另外,有EGFR突变或ALK基因重排患者可从联合Atezolizumab治疗中显著获益,肝转移患者亦是如此。要知道,肝转移患者有免疫抑制肿瘤环境,预后较差。目前看该研究中联合Atezolizumab治疗还可带来总生存获益,研究结果将在之后的学术会议上公布。还有一个试验组,评估Atezolizumab联合单纯化疗,没有贝伐珠单抗治疗的研究还在进行。
该研究入组Ⅳ期或复发转移性非鳞NSCLC患者,患者此前未接受过化疗,有肿瘤组织可进行标志物检测。1202例患者随机分为3组,分别接受Atezolizumab联合卡铂+紫杉醇化疗继以Atezolizumab维持治疗,Atezolizumab联合贝伐珠单抗+化疗继以Atezolizumab+贝伐珠单抗维持治疗,贝伐珠单抗+化疗继以贝伐珠单抗维持治疗。主要研究终点为无进展生存,目前研究者报告的是预设生物标志物和特定亚组的分析结果。Atezolizumab+化疗组随访还在继续。
(编译 张茹倩)
CheckMate-141研究会上公布2年总生存数据
Ⅲ期开放随机临床研究CheckMate-141旨在评估Nivolumab与研究者选择的化疗(西妥昔单抗、多西他赛或甲氨蝶呤)用于治疗含铂化疗失败后的复发或转移性头颈部鳞癌(SCCHN)患者的疗效。(摘要号 CT116)
2年随访后,Nivolumab治疗患者死亡风险较对照组降低32%(HR=0.68, 95%CI 0.54~0.86),中位总生存分别为7.7个月和5.1个月,2年总生存率分别为16.9%和6.0%,安全性数据与此前Nivolumab治疗肺癌和黑色素瘤研究中的分析结果一致。3~4级不良反应发生率Nivolumab和对照组分别为15.3%和36.9%。
有评论者指出,Nivoumab是目前唯一治疗头颈部鳞癌有显著总生存获益的免疫疗法,头颈部鳞癌治疗引入免疫疗法意义重大,该研究中Nivolumab带来的总生存获益令人鼓舞,因为这类患者通常中位生存超不过6个月。研究也分析了不同PD-L1表达状态患者中Nivolumab治疗疗效,2年随访时,PD-L1表达≥1%的患者中,Nivolumab治疗组死亡风险较对照组降低45%(HR=0.55,95%CI 0.39~0.78),PD-L1<1%的患者中,死亡风险降低27%(HR=0.73,95%CI 0.49~1.09)。提示不管PD-L1水平和HPV状态如何,Nivolumab均可为头颈部鳞癌患者带来显著生存获益。 (编译 张茹倩)
Epacadostat研究再次受挫
会上报告的Ⅰ/Ⅱ期研究ECHO-203研究显示,IDO1抑制剂Epacadostat治疗胰腺癌未带来显示临床疗效。(摘要号 CT177)
这是Epacadostat第二次临床试验受挫了,就在这个月,Ⅲ期研究ECHO-301/KEYNOTE-252研究显示,Pembrolizumab基础上联合Epacadostat未显著改善黑色素瘤患者无进展生存。目前的胰腺癌试验中,Epacadostat 联合Durvalumab耐受性良好,但未观察到客观缓解,Ⅱ期扩展研究未开展。
入组Ⅰ期研究的34例患者中,15例胰腺癌,1例黑色素瘤,10例非小细胞肺癌,8例头颈部鳞癌。会上研究者只分享了胰腺癌患者治疗数据,所有15例患者数据截止时都因发生了疾病进展、医生决定或死亡而停止治疗。胰腺癌患者中未发现客观缓解病例,5例疾病稳定,中位疾病控制时间为22周。
34例患者中,5例完成了12个月的联合治疗进入Epacadostat单药治疗。29例数据截止时因疾病进展、医生决定、不良反应或死亡不再接受治疗。Epacadostat中位治疗时间为12.1周。
(编译 张茹倩)


