DESTINY-Breast03研究第二次总生存中期分析结果公布

会上报告的DESTINY-Breast03研究第二次总生存中期分析结果,与T-DM1治疗相比,T-DXd二线治疗显著改善HER2阳性晚期乳腺癌的无进展生存期(PFS)和总生存,其随访数据刷新了T-DXd二线治疗的无进展生存获益记录,进一步夯实了T-DXd的二线治疗标准地位。(摘要号 GS2-02)
DESTINY-Breast03研究是T-DXd在乳腺癌治疗领域的第一个随机、对照Ⅲ期临床试验,在HER2阳性晚期乳腺癌中对比T-DXd与T-DM1的疗效与安全性。该研究于2018年7月20日至2020年6月23日期间从全球169个研究中心入组HER2阳性乳腺癌不可切除或转移、经过曲妥珠单抗和紫杉类治疗的患者524例,按1∶1的比例随机分入两组,其中261例接受T-DXd 5.4 mg/kg,其余263例接受T-DM1 3.6 mg/kg,均为每3周通过静脉输注给药。
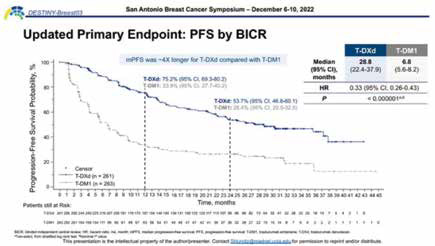
根据激素受体状态、既往帕妥珠单抗治疗和内脏疾病史对随机分组进行分层。主要终点为盲态独立中心评估(BICR)的PFS;关键次要终点为OS;次要终点为BICR和研究者评估的OS、BICR评估的缓解持续时间(DoR)和安全性。
本次会上报告的更新无进展生存数据引人瞩目,主要研究终点方面,T-DXd组的BICR评估的中位PFS长达28.8个月,是T-DM1组6.8个月的4倍余,进展或死亡风险显著降低67%(95%CI 0.26~0.43;P<0.000001)。研究者评估的PFS具有相同趋势,两组PFS分别为29.1个月 vs. 7.2个月(HR=0.30,95%CI 0.24~0.38,P<0.0001)。
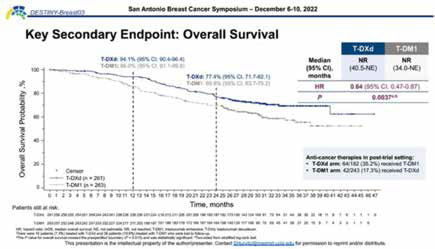
该研究中关键次要研究终点OS达到统计学显著差异。预先指定的生存分析计划对153个OS事件进行中期分析(显著性界限P=0.008)。截至2022年7月25日,共观察到169例OS事件,根据实际事件数校正的显著性界值P=0.013。
在本次公布的OS数据更新中,相比T-DM1,T-DXd组显示出了明显的生存获益趋势,P值为0.0037,超过预先规定的显著性界限,降低患者死亡风险36%(HR=0.64,95%Cl 0.47~0.87);2年OS率为77.4%,意味着2/3的患者生存达2年。
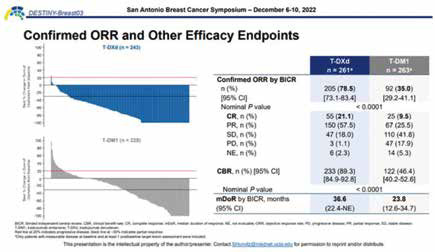
在疾病缓解方面,T-DXd提供了具有临床意义和持久的客观缓解。T-DXd组中BICR评估的ORR达78.5%,超过T-DM1组(35.0%)的2倍。值得注意的是,T-DXd组中每5例患者中有1例达到完全缓解(CR),也是T-DM1组的2倍多(21.1% vs. 9.5%),显示了可期的治愈潜力。

该研究中两组研究者评估的中位PFS2分别为40.5个月和25.7个月(HR=0.47,95%CI 0.35~0.62)。两组分别有70.8%和78.6%的患者接受了后续抗肿瘤治疗,其中T-DM1组有17.3%的患者使用了T-DXd。即便T-DM1组二线治疗进展后允许交叉接受T-DXd治疗,T-DXd组仍然具有更长的PFS2。
最新随访数据显示,两组的安全性与此前报告的基本一致,未出现新的不良反应。也没有因药物不良反应死亡的病例。并且两组≥3级不良事件发生率均相当。T-DXd组的常见不良反应仍旧是1~2级的消化道、血液学和乏力等一般性不良反应为主。T-DXd组的间质性肺病(ILD)/肺炎发生率从第一次中期分析的10.5%增加到15.2%,在长达2年多的随访过程中,T-DXd组未新增3级事件,没有发生4级或5级ILD/肺炎。可以说,随着治疗时间的延长,T-DXd继续表现出可管理和可耐受的安全性。
会上报告的这些最新数据显示,与T-DM1相比,T-DXd使超过1/5的患者实现疾病完全缓解,并显著改善了HER2阳性转移性乳腺癌患者的生存时间,无疑进一步夯实其二线治疗地位。无论患者激素受体状态、帕妥珠单抗经治与否、内脏转移与否、经治线数、伴稳定性脑转移与否,各亚组的OS获益趋势一致,T-DXd均较T-DM1表现出了更佳的疗效。
该研究是全球首个在HER2阳性晚期乳腺癌二线治疗中将T-DXd与T-DM1进行头对头比较,并取得具有显著临床意义阳性结果的Ⅲ期临床试验。基于这一重磅成果,T-DXd已经取代了T-DM1在HER2阳性晚期乳腺癌的二线标准治疗地位,改写ESMO、ABC6、NCCN及ASCO等一系列权威指南,成为国际二线治疗新标准,推动HER2阳性晚期乳腺癌进入ADC药物治疗的主流时代。 (编译 张萍)


