研究发现新的抑癌机制或有免疫疗法指导价值
美国哈佛大学Zon等报告的研究首次证实RNA监控具有抑癌作用,这种RNA监控广泛存在于不同物种和细胞类型中,在细胞周期蛋白依赖性激酶13(CDK13)发生突变的癌细胞中,转录过程中过早终止的RNA(ptRNAs)翻译生成的新抗原或有利于肿瘤免疫治疗。(Science. 2023;380:eabn7625)
因CDK13突变而富集在细胞中的ptRNAs可进入细胞质,并翻译成携带有内含子信息的蛋白,加速癌症的进展。在CDK13及其下游基因没有突变的情况下,它们可发挥核RNA监控作用,降解致癌的ptRNAs。
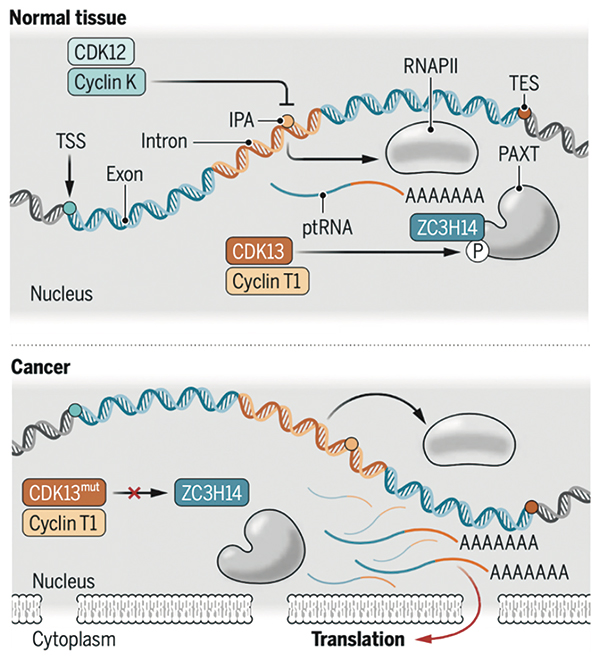
研究者此前发现,约3.9%的黑色素瘤患者携带CDK13突变,且影响CDK13功能的突变位点很特殊,几乎都集中在激酶结构域,提示CDK13突变保留了其细胞周期蛋白结合功能,但其激活下游蛋白的激酶功能却丢失了。
研究者回顾性分析了黑色素瘤患者的生存数据发现,CDK13表达降低或发生体细胞突变的患者,总生存较短,提示CDK13是重要的黑色素瘤驱动基因。研究者发现,所有肿瘤的CDK13突变都是杂合的,未发现纯合缺失,提示纯合CDK13突变可能是致死的,杂合突变可能通过显性负效应(突变CDK13抑制野生CDK13功能)发挥促癌作用。
研究者从转录组层面研究了CDK13突变带来的改变,发现在CDK13突变的黑色素瘤中,ptRNAs显著增多。且这些ptRNAs并非来自某几个特定基因,而是来自众多基因。ptRNAs转录断点在一个名为内含子多聚腺苷酸化(IPA,内含子中poly A所处的位置)的位点。
IPA是真核生物基因表达转录调控方式之一,近年来有研究发现异常ptRNA与肿瘤等疾病相关。
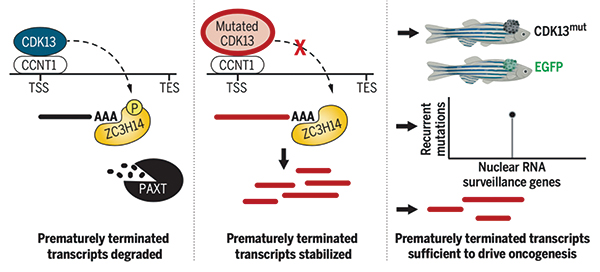
研究者发现,黑色素瘤细胞积累的ptRNAs不是转录本断裂引起,而是ptRNAs清除不力所致。CDK13突变导致PAXT复合体招募和激活受损,而PAXT复合体就是负责清楚ptRNAs的关键蛋白。
由于ptRNAs中包括了基因的内含子部分序列,ptRNAs在细胞质中翻译生成的蛋白产物中,也包含内含子。这可能会导致肿瘤特异性新抗原的产生,或许CDK13突变的肿瘤患者免疫疗法效果更好。
研究者探讨了CDK13及其下游蛋白突变是否与其他类型肿瘤相关,以及ptRNAs能否直接促癌。分析膀胱癌、结直肠癌、黑色素瘤、肺癌和子宫内膜癌患者肿瘤样本RNA-seq数据和CDK13突变情况的数据发现,ptRNAs在CDK13突变的肿瘤中显著上调。研究者分析了TP53这个基因的ptRNAs发现,在CDK13突变的肿瘤中TP53 ptRNA水平明显更高。
除了CDK13突变外,其下游负责清除ptRNA的PAXT突变也致癌,在17%的黑色素瘤中存在PAXT复合体成员被删除或发生突变。与PAXT复合体相互作用的一些关键蛋白,在多种肿瘤中也发生了突变。
在黑色素瘤细胞中表达TP53 ptRNA后发现,黑色素瘤发生确实加速了。在黑色素瘤细胞中表达膜蛋白基因SUV39H1 ptRNA,也加速黑色素瘤的发生。提示ptRNA确实致癌,研究者认为核RNA监控缺陷是一种普遍的致癌机制。
研究者发现了一个广泛存在于多瘤种的新型抑癌/致癌机制,加之CDK13及其下游基因突变在肿瘤中发生频率并不低(在黑色素瘤中突变频率超过20%),这一研究发现或开辟了一个新的肿瘤治疗研究方向。肿瘤中ptRNAs的积累可能会产生大量新抗原,或许有类似肿瘤突变负荷(TMB)那样的针对肿瘤免疫治疗的指导价值。 (编译 王宇)


