检测表达DLL3的神经内分泌癌 [89Zr]Zr-DFO-SC16.56示踪有潜在作用
美国纪念斯隆·凯特琳癌症中心Tendler等报告,在神经内分泌癌患者中,δ样配体3(DLL3)正电子发射计算机体层显像(PET-CT)是安全可行的。DLL3靶向成像示踪剂[89Zr]Zr-DFO-SC16.56在表达DLL3的恶性肿瘤中有潜在作用。(Lancet Oncol. 2024年6月28日在线版)
DLL3在小细胞肺癌(SCLC)和神经内分泌前列腺癌细胞表面异常表达。为了评估DLL3靶向成像示踪剂[89Zr]Zr-DFO-SC16.56在神经内分泌源性癌症患者中的安全性和可行性,该项开放标签的、首次在人体中开展的Ⅰ/Ⅱ研究在纪念斯隆·凯特琳癌症中心纳入≥18岁的、ECOG PS评分为0~2分的、组织学证实的神经内分泌源性恶性肿瘤患者。
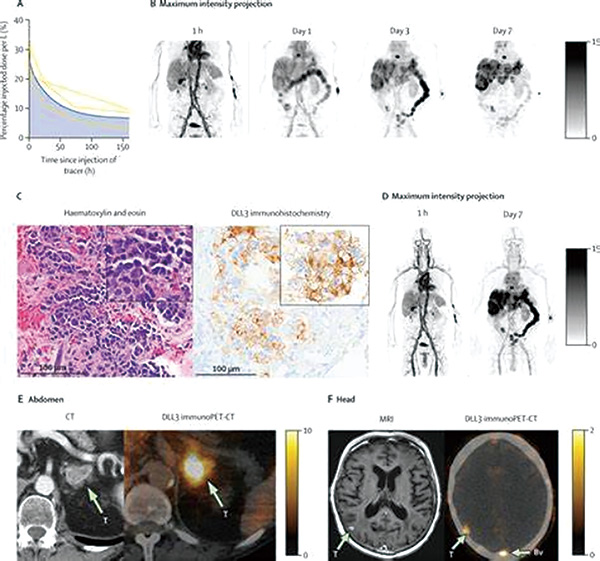
初始队列(队列1)纳入SCLC患者,单次静脉输注37~74 MBq的[89Zr]Zr-DFO-SC16.56,总质量剂量为2.5 mg,并在输注后1小时、第1天、第3天和第7天进行系列PET-CT扫描。Ⅰ期(队列1)的主要终点为终末清除半衰期和安全性。
扩展队列(队列2)额外纳入了SCLC、神经内分泌前列腺癌、非典型类癌和非小细胞肺癌患者,参照队列1给予同样放射活性和质量剂量的[89Zr]Zr-DFO-SC16.56,在3~6天后进行单次PET-CT扫描。Ⅱ期(队列2)的主要终点为确定肿瘤对示踪剂的摄取和肿瘤内DLL3蛋白表达之间的潜在联系。
结果显示,2020年2月11日至2023年1月30日,12例(67%)男性和6例(33%)女性患者入组,中位年龄为64岁(23~81岁)。队列1有3例患者,队列2有另外15例患者。
队列1中的3例SCLC患者的成像显示在注射示踪剂后第3天和第7天肿瘤归因[89Zr]Zr-DFO-SC16.56摄取信号强。血清清除呈双相性,估计的终末清除半衰期为119小时±31小时。肝脏出现最大平均吸收剂量,为1.83 mGy/MBq±0.36 mGy/MBq,平均有效剂量为0.49 mSv/MBq±0.10 mSv/MBq。
在队列2的15例患者中,示踪剂给药后第3~6天的单次immunoPET-CT扫描可以勾勒出12例(80%)的DLL3嗜性肿瘤。不同患者间、患者内部以及不同解剖部位的肿瘤摄取值存在差异,最大标准化摄取值范围较大(3.3~66.7)。在16例具有可评估组织的患者中,15例(94%)的[89Zr]Zr-DFO-SC16.56肿瘤摄取与DLL3免疫组化结果一致。1例非嗜性DLL3小细胞肺癌患者和1例PET扫描显示神经内分泌前列腺癌的患者,经肿瘤免疫组织化学评估DLL3的表达最低。18例患者中有1例(6%)发生1级变态反应,两组均未出现≥2级的不良事件。
奥地利维也纳国际原子能机构Giammarile等表示:这项研究兼具科学性和新颖性,并有改善患者预后、提高治疗效果和最小化治疗相关毒性的潜力,因而引人瞩目。尽管样本量很小,但细致的研究设计彰显了研究人员对严格科学探究的执着。非侵入性可视化和量化DLL3表达的能力开启了许多临床可能性。临床医生可以使用免疫PET成像,根据DLL3表达水平对患者进行分层,根据个人情况制订治疗计划。这种分层可以导致更有效地开展靶向治疗,使患者免于不必要的治疗及其相关的不良事件。此外,这项研究的见解为靶向治疗和个性化药物策略的发展铺平了道路,这只需将用于诊断的放射性同位素(即89Zr)与用于治疗的放射性同位素(即β射线或α射线)交换即可。
不过,该领域必须解决几个挑战,以充分实现以DLL3为靶点的治疗诊断学的潜在应用。这些挑战包括需要进行大规模临床试验来验证目前的发现,开发标准化的成像和治疗程序协议,以及建立强大的监管途径来批准新的治疗诊断药物。总之,该研究是神经内分泌肿瘤学的一个里程碑,为DLL3表达及其临床意义提供了重要的见解。通过尖端成像技术阐明DLL3表达的复杂性,研究人员瞥见了癌症管理的一角前景,提供了一种整合诊断和治疗的整体方法。通过持续的创新和合作,治疗诊断学有望彻底改变癌症医疗,最终提高癌症患者的生存率和生活质量。
(编译 张美涵)


