适合双免疫方案的优势患者人群研究
美国MD Anderson癌症中心Skoulidis等研究揭示了PD-1/L1抑制剂和CTLA-4抑制剂双免疫方案的优势患者人群特征,研究结果有望指导临床精准用药,双免疫方案(或与化疗协同)可能适用于非小细胞肺癌(NSCLC)中相当多见且不利于免疫治疗起效的STK11和(或)KEAP1突变阳性晚期NSCLC患者。(Nature. 2024年10月9日在线版)
PD-1/L1抑制剂和CTLA-4抑制剂双免疫方案一方面取得了对NSCLC、肝癌等实体瘤的不错的疗效,但相较于PD-1/L1抑制剂单药治疗,双免疫方案的副作用发生率更高,选择适合双免疫方案的优势患者人群是关键。
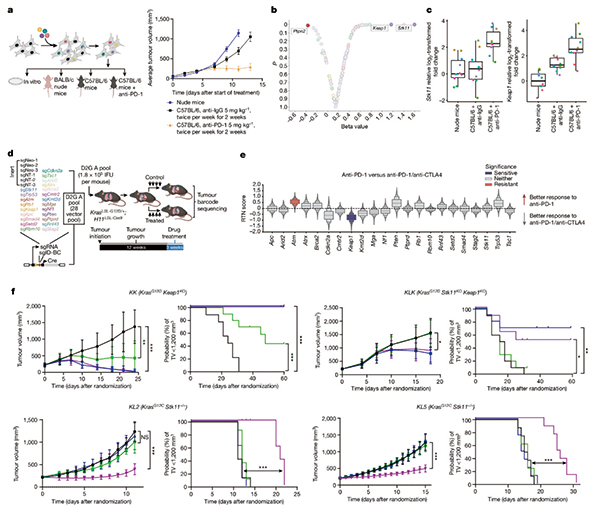
研究者分析了临床Ⅲ期关键研究POSEIDON数据,证实KEAP1缺失是基因组层面对双免疫方案疗效最有力的预测指标;从作用机制上看,STK11/KEAP1突变会导致抑制性髓系细胞增多、CD8+ T细胞减少,使微环境呈免疫抑制性,而在PD-1/L1抑制剂治疗的基础上加用CTLA-4抑制剂,可通过重编程髓系细胞和激活CD4+效应T细胞逆转免疫抑制。
STK11和KEAP1均为抑癌基因,但有研究显示,它们一旦发生变异(以功能缺失突变为主),就会阻碍免疫治疗对NSCLC患者见效,且此前尚无适合STK11和(或)KEAP1突变阳性患者的联合治疗策略,免疫+化疗方案也被证实效果不佳。
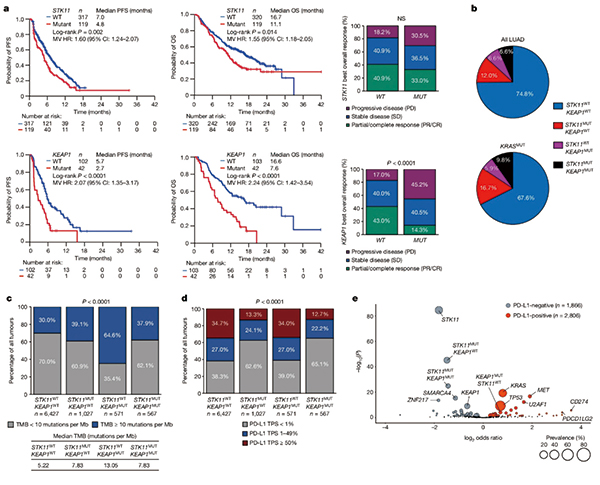
研究者调取了Foundation Medicine队列中8000余例肺腺癌患者的基因组和免疫资料,发现KEAP1突变阳性NSCLC的肿瘤突变负荷(TMB)比STK11/KEAP1野生型肿瘤明显更高,所以可排除TMB的影响,而STK11突变阳性肿瘤的PD-L1表达水平明显偏低,PD-L1阴性肿瘤中尤其多见STK11突变,可能部分解释了免疫治疗的效果不佳。
评估度伐利尤单抗+CTLA-4抑制剂tremelimumab+标准化疗方案(TDCT)一线治疗晚期NSCLC的POSEIDON研究,提供了现成的数据源,在研究纳入的612例基因突变状态可评估患者中,分别有14%和6%患者存在STK11和KEAP1突变,而TDCT方案在STK11/KEAP1突变双阳性患者中的疗效数据相对最好。
实验明确证实,STK11和KEAP1缺失或失活都可以直接导致免疫逃逸和免疫治疗耐药,其中STK11直接促进肿瘤增殖的作用更明显,而KEAP1对双免疫方案的起效影响更大。在荷瘤模型小鼠上测试不同的免疫单药或联合治疗策略时,研究者发现CTLA-4抑制剂单药治疗就足以抑制KEAP1缺陷型肿瘤,联合PD-1/L1抑制剂±化疗则效果更好;而对STK11/KEAP1突变双缺陷型肿瘤,只有CTLA-4抑制剂联合PD-1/L1抑制剂的双免疫方案才有明显效果,换成LAG-3或TIM-3抑制剂联合PD-1/L1抑制剂均不佳。
免疫表型分析则显示,STK11/KEAP1双缺陷型肿瘤的典型特征是微环境内存在大量抑制性髓系细胞,CD8+细胞毒性T细胞则数量稀少,显然是免疫冷肿瘤,但多个不同亚型的CD4+ T细胞有所增加,它们也是CTLA-4抑制剂+PD-1/L1抑制剂双免疫方案处理后主要被激活的对象,其中的CD4+效应T细胞和CD8+ T细胞,均对后续抗肿瘤免疫应答至关重要。
双免疫方案处理还显著增加了诱导型一氧化氮合酶(iNOS)阳性抗原呈递细胞,以及单核细胞、中性粒细胞和MHC- Ⅱ阳性肿瘤相关巨噬细胞的数量,且一部分iNOS阳性髓系细胞具有直接杀伤癌细胞的能力,抑制iNOS也会削弱双免疫方案的疗效。
对于当前难被免疫治疗或其他精准治疗惠及的STK11和(或)KEAP1突变NSCLC患者,该研究的双免疫方案可能是新的选择,不过在改写临床实践和指南推荐前,可能还需大样本前瞻性研究入组这类患者从而提供高质量证据。 (编译 张俊熙)


