ESMO 免疫治疗的毒性管理指南解读
北京大学肿瘤医院 彭智 王正航 袁家佳 刘丹 王雅坤 姬智 张静 王晰程 龚继芳 沈琳
随着免疫治疗在肿瘤治疗中取得的成功,越来越多的患者已经在使用或即将可能使用该疗法。免疫治疗因其毒性与传统化疗不同,带来了新的临床问题,也为肿瘤科医生带来了新的挑战——如何了解认识免疫治疗的毒性特点,从而更好地控制和处理免疫治疗带来的不良反应。

近期,欧洲临床肿瘤协会(ESMO)发表了《免疫治疗的毒性管理:ESMO 诊断、治疗及随访临床实践指南》(以下简称该指南)。在沈琳教授的指导下,中国临床肿瘤学会(CSCO)翻译小组对该指南进行了翻译,得到了广大肿瘤科医生的大力支持。
该指南提出的免疫相关毒性主要分为免疫相关皮肤毒性、内分泌疾病、肝脏毒性、胃肠道毒性、肺炎以及罕见的免疫相关毒性(神经系统毒性、心脏毒性、风湿免疫毒性、肾毒性、眼毒性)等。各个章节分为发生率、诊断、处理措施三大部分。最后总结出按照不同症状等级进行的分级处理步骤,对临床应用有明确的指导价值。
但是,目前免疫检查点抑制剂(immune checkpoint inhibitors,ICPis)的临床应用时间有限,在我国尚未得到国家食品药品监督管理总局的批准,多为临床研究用药。现有的指南数据有限,国内的医生对于免疫治疗的毒性认识尤显不足,在有限数据的基础上如何更好地理解指南、预测和控制不良反应的发生以及避免不良反应对患者治疗的影响,都有待进一步的认识和提高。
因此,笔者对该指南进行了解读,本文将重点阐述临床中处理免疫相关不良反应时需要注意的事项,并指出该指南的不足之处。希望随着使用经验的不断积累,在广泛交流的基础上,能够进一步深入研究毒性预测的标志物、预防方法等热点问题。
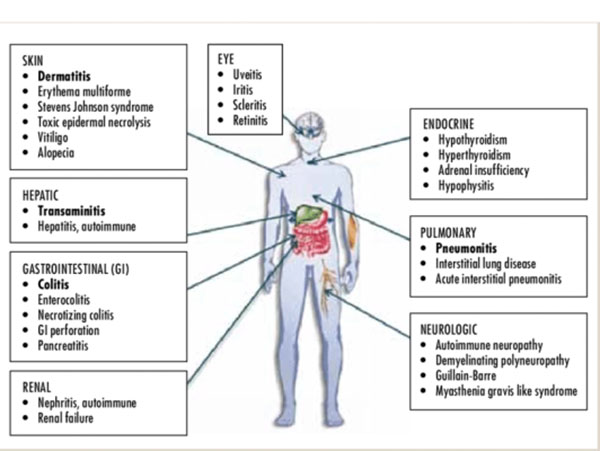
1 免疫相关皮肤毒性
皮肤不良反应多表现为早发型不良反应(发生于治疗开始后的前几周),是免疫检查点细胞毒性T 淋巴细胞相关抗原4(cytotoxic T lymphocyte antigen-4,CTLA-4)和程序性死亡蛋白-1(PD-1)单抗抑制剂最常见的不良事件,Ipilimumab 发生率为43%~45%,Nivolu mab和Pembrolizumab 为34%。但严重的皮肤不良反应较为罕见,且通常不需要停止治疗或药物减量。
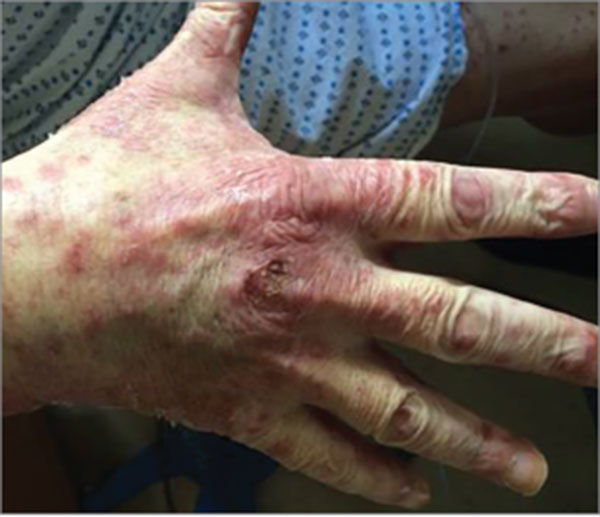
最常见的皮肤不良反应是皮疹、瘙痒及白癜风,白癜风最常见于黑色素瘤患者。其他更少见的皮肤不良反应包括:斑秃、口腔炎、皮肤干燥症及光敏感。也有报道称,出现了银屑病的加重以及在既往无皮肤病病史的患者中发生了银屑病样或苔藓样皮肤不良反应。根据其组织病理学表现,皮肤不良反应可分为以下4 大类:炎性皮肤病,免疫性大疱性皮肤病,角质形成细胞改变,由黑素细胞改变引起的免疫反应。
值得关注的是,在接受抗PD-1 单抗治疗的黑色素瘤患者中,一种免疫相关的皮肤不良反应——白癜风似乎与较好的临床疗效有关。白癜风在抗PD-1 单抗和联用ICPis 时的发生率约为8%,在Ipilimumab 单药中极少有报道。
在一项小型前瞻性研究中,Pembrolizumab 治疗后有25% 的患者出现了白癜风,其发生率与药物疗效明显相关。由于皮肤科医生很少对患者进行常规、系统的皮肤检查,因而临床试验中白癜风的发生率可能被低估了。白癜风主要发生于使用ICPis 的黑色素瘤患者中,而其他瘤种则少见。
除白癜风外,该指南并未提及其他类型皮肤不良反应能否预测疗效,如皮疹。在应用表皮生长因子受体(EGFR)单抗的患者中,皮疹的发生与疗效有关,而对于ICPis 的疗效预测作用并不明确。部分原因可能是两类药物的作用机制及引发皮疹的机制不同。事实上,应用不良反应发生率来预测疗效本身存在争议,因为病情进展的患者往往提前终止用药,从而低估了不良反应发生率。因此,不良反应对疗效的预测价值有待探讨。
诊断建议
免疫相关皮肤不良反应的诊断主要依靠用药史及临床表现。该指南建议,使用ICPis 的患者出现皮肤不良反应时,首先需要除外皮肤疾病的其他原因,如感染、其他药物的反应或其他皮肤疾病的表现。对皮肤黏膜进行全面仔细的检查非常必要,包括评估有无发热及淋巴结肿大等情况。
必要时进行血细胞计数、肝肾功能检查。这能够帮助排除皮肤急症,如伴嗜酸性粒细胞增多和系统症状的药疹(drug rash with eosinophilia and systemic symptoms,DRESS)、急性发热性中性粒细胞增多性皮肤病(acute febrile neutrophilic dermatosis,Sweet 综合征)、Stevens-Johnson 综合征或中毒性表皮坏死松解症(toxic epidermal necrolysis,TEN)。出现上述致命情况时(已有致死性报道),应永久停用ICPis,并立即收住院,请专业皮肤科医生协助治疗。
此外,该指南对最常见的皮肤不良反应——皮疹的评价标准提出了自己的观点。通常使用不良事件通用术语标准(Common Terminology Criteria for Adverse Events,CTCAE)来准确评估皮肤不良反应。根据目前使用的CTCAE 第4 版内容,当皮疹累及>30% 体表面积时,将被自动划分为3 级。
这种分级方法是否一定合适尚需讨论。该指南认为,尽管皮疹分布范围广,但是程度轻微且无任何其他症状时,定义为2 级皮肤不良反应较3 级更为合适。我们也期待第5 版CTCAE 对于皮肤不良反应会给出更加合适的分类。

处理方法
免疫相关皮肤不良反应多数较轻,严重致死事件罕见。处理方法主要包括对症治疗,以及局部或全身应用糖皮质激素,根据病情的轻重调整激素用法用量。1 级皮肤不良反应不影响用药,只需局部对症处理。2 级皮肤不良反应可以边用药边观察,如无缓解,需暂停用药。3 级以上皮肤不良反应需立即停药,并全身应用糖皮质激素,直至降至1 级。4 级皮肤不良反应较为罕见,需立即停药,并尽快入院请皮肤科医生协助治疗。治疗方法包括静脉注射(甲基)泼尼松龙1~2 mg/kg,注意逐渐减量。
该指南在处理流程规范部分明确提出,对于2级及以上的皮疹建议进行皮肤活检。这不仅有助于明确诊断,同时也有助于研究免疫不良反应相关机制。皮疹的病理活检显示:血管周围广泛淋巴细胞浸润,累及表皮和真皮层,并且在凋亡的黑色素瘤细胞周围可见CD4+ 和黑色素A 特异性CD8+T 细胞浸润。此外,在使用抗CTLA-4 抗体发生皮疹的患者中观察到血清嗜酸性粒细胞水平明显升高,而在使用抗PD-1 抗体的患者中未观察到这一现象。同时,该指南还强调了皮肤科专业会诊在免疫相关毒性管理方面的重要性。
由于ICPis 的有效率低,不良反应谱非常广泛,对于疗效和毒性预测标志物的研究成为未来研究热点之一。鉴于目前对于皮肤毒性预测标志物的探索尚无明确结论,该指南对此并未提及。小样本研究发现,应用抗CTLA-4 抗体的患者发生皮疹时血清嗜酸性粒细胞水平明显升高,而在抗PD-1 抗体的患者中并未发现这一现象,可能与两种药物的作用机制不同有关,未来需进一步探索明确的疗效及毒性预测标志物。
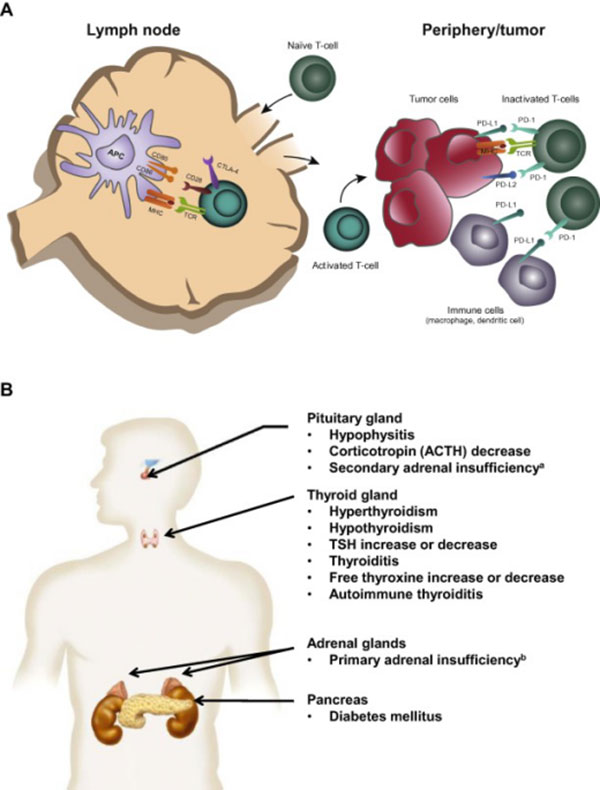
2 免疫相关内分泌疾病
免疫相关内分泌疾病主要包括甲状腺疾病、垂体炎、1 型糖尿病、肾上腺功能不全等,该指南对于前两者有较为详尽的阐述,并给出了监测与处理流程图。
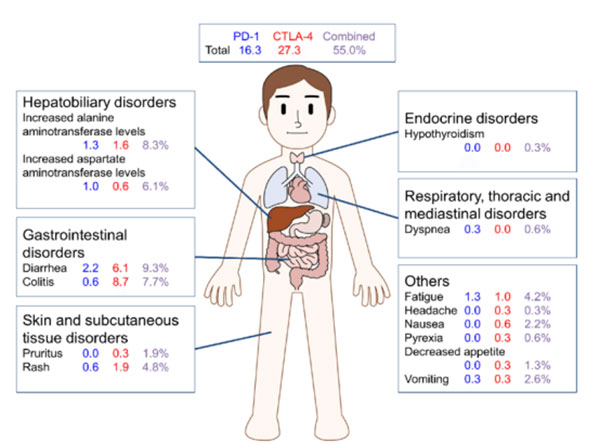
应用ICPis 治疗的患者发生的甲状腺疾病既包括甲状腺功能亢进也包括甲状腺功能减退,以后者更为常见。甲状腺功能亢进通常是暂时性的,但是可能进展为甲状腺功能减退。据报道,抗CTLA-4 单抗药物治疗甲状腺功能障碍的发生率为1%~5%,其发生率随着治疗剂量的增加而增加,抗PD-1 或抗PD-L1 单抗治疗时,甲状腺功能紊乱发生率为5%~10%,而免疫联合治疗时甲状腺疾病的发生率增加至20%。
但是这些不良反应分级很少超过2 级,且缺乏特异性,因此很难仅凭临床症状发现,大多数是通过血液学常规检查[ 促甲状腺激素(TSH)和游离甲状腺素(FT4)] 发现的。而且甲状腺疾病可能在治疗过程中的任何时间发生,因此在临床实践中需要定期检查应用ICPis 治疗的患者的甲状腺功能。

甲状腺疾病
该指南建议每次用药前或至少每个月检查1 次(每2 周用药1 次的患者)甲状腺功能。如果患者有疲劳或其他甲状腺功能减退相关主诉,即使是亚临床甲状腺功能减退也需要考虑使用激素替代治疗(甲状腺素0.5~1.5 μg/kg)并长期维持。如果患者表现为甲状腺功能亢进,则需要使用β 受体阻滞剂,但是需要通过检测抗TSH 受体抗体、抗血小板生成素(thrombopoietin,TPO)抗体、甲状腺核素扫描与甲状腺炎、Graves 病相鉴别。
如果表现为伴有疼痛的甲状腺炎,需要考虑泼尼松龙0.5 mg/kg 治疗,若症状仍然没有好转,需要中断ICPis 治疗,直至症状消失再考虑重新用药。除了以上针对不同甲状腺疾病症状给出的监测与处理流程,该指南还针对不同的TSH、FT4 变化水平给出了处理流程,对于临床实践工作中遇到的甲状腺功能检测结果异常而患者无不适主诉的情况具有很强的指导意义。
垂体炎
垂体炎多发生于接受抗CTLA-4 单抗药物治疗的患者中,发生率随着治疗剂量的增加而增加(1% ~16%)。垂体炎典型表现为乏力、厌食、头痛、视力障碍等,实验室检查提示血中TSH、促肾上腺皮质激素和(或)卵泡刺激素/ 黄体生成素比值(FSH/LH)同时降低。由于典型的临床表现与实验室检查结果在现实中少之又少,因此需要临床医生提高警惕,并与脑转移、软脑膜疾病、脑血管病等相鉴别,当怀疑患者发生垂体炎时需行脑部磁共振检查,通常表现为肿胀或扩大的脑垂体。
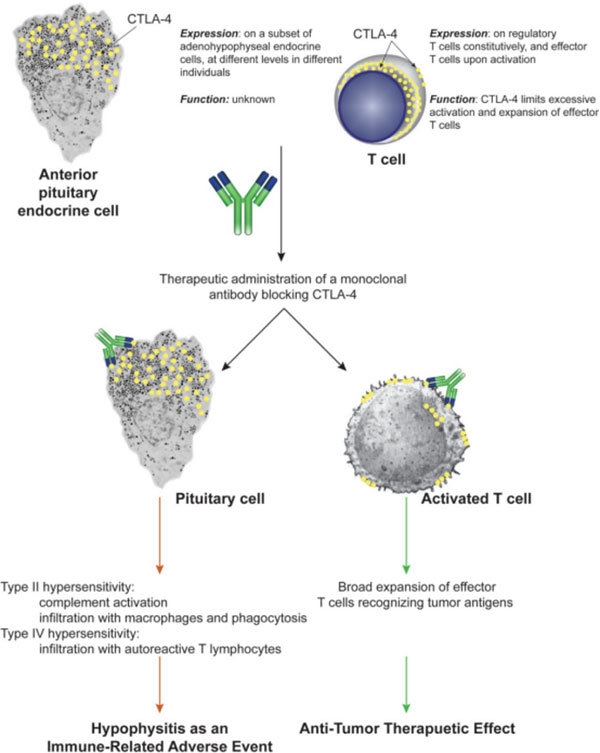
该指南根据症状将垂体炎分为轻度(乏力、厌食)、中度(头痛、情绪改变)、重度(视力障碍、肾上腺功能减退)3 个级别。轻度症状可继续ICPis 治疗,同时给予适当的激素替代治疗(氢化可的松、甲状腺素);中度以上症状需立即中断ICPis 治疗,中度症状需口服0.5~1 mg/kg 泼尼松龙;而重度症状需静脉给予1 mg/kg(甲基)泼尼松龙治疗,根据症状控制情况逐步减量至5 mg,但不能停止激素治疗。由于垂体炎涉及机体内多种内分泌激素之间的相互调节,因此最好能够有内分泌专家的会诊指导。
原发性糖尿病
ICPis 治疗引起原发性糖尿病的概率很低(< 1%),采用抗PD-1 和PD-L1 治疗引起的糖尿病较抗CTLA-4 治疗更多见。对于接受ICPis 治疗的患者,建议常规检测血糖水平,需要警惕可危及生命的酮症酸中毒的出现,一旦出现酮症酸中毒,需要根据指南标准及时处理。类固醇激素很可能对这些患者糖尿病的控制产生不良影响,在指南中未作推荐。对于经胰岛素治疗后血糖得到控制的患者,可考虑重新开始ICPis 治疗。
3 免疫相关肝脏毒性
ICPis 相关的肝炎主要表现为转氨酶水平升高伴胆红素水平轻度升高,临床上通常无明显症状。因治疗前常规进行肝功能检查,一旦发生肝功能受损,通常能够及时发现。该指南指出,免疫相关肝炎通常发生于治疗后8~12 周,最常见于抗CTLA-4 单抗(Ipilimumab),接受常规剂量Ipilimumab、Nivolumab 和Pembrolizumab 单药治疗
的患者肝炎发生率为5% ~10%(其中3 级反应发生率为1%~2%)。Ipilimumab 3 mg/kg 和Nivolumab 1 mg/kg 联合治疗的患者肝炎发生率为25%~30%(其中3 级反应发生率为15%。
诊断推荐
该指南推荐所有接受ICPis 治疗的患者在每个治疗周期前检测血清转氨酶和胆红素水平,以评估是否有肝功能受损。肝炎通常是无症状的,也有部分患者表现为低热、乏力,可能与转氨酶水平相关。
虽然少见,但暴发性肝炎甚至死亡病例也有报道。一旦出现转氨酶水平升高,除与试验药物相关外,其他肝毒性药物损伤、自身免疫性肝炎、病毒性肝炎、酒精性肝病等都应列入临床医生考虑的范围。
详细的病史采集(嗜酒、药物服用史、自身免疫病病史等)、临床表现(黄疸、腹水)、血清学检测(自身抗体、胆红素水平、AST/ALT 比例等)、影像学检查(肝脏大、肝硬化表现、肝脏新发占位等)都可以作为鉴别诊断的依据。然而,如果没有明显的致病因素,该指南推荐必须的保肝治疗,无需等到血清学结果即可开始。
该指南还指出,为了与严重的肝炎反应相鉴别,可考虑行肝组织活检。多项研究表明,多数病例是全小叶型肝炎,而炎症可能局限于3 段。此外,肝窦组织细胞增生症和中央静脉炎有助于诊断Ipilimumab 相关炎症。而小叶性肝炎和自身免疫性肝炎很难区分;极少数病例可表现为汇管区感染、胆管炎,则很难与非酒精性脂肪性肝炎相鉴别。这时,临床信息采集及与病理科、肝脏科医生的多学科讨论至关重要。
治疗和随访指导
关于免疫相关肝脏毒性,该指南根据CTCAE分级进行了治疗和随访的指导。对于转氨酶或总胆红素水平轻度(1 级)升高的患者,如果没有相关的临床症状,可继续免疫治疗,但需定期监测肝功能直至恢复正常。一旦恶化或出现发热、乏力等表现,应重新进行分级和治疗。
对于转氨酶或总胆红素水平中度(2 级)升高的患者,需停止使用ICPis,并每周检测2 次血清转氨酶和总胆红素水平;转氨酶或总胆红素水平2 级升高持续超过1~2周,在排除其他致病因素后,需使用皮质类固醇激素治疗,剂量为1 mg/(kg•d)(甲基)泼尼松龙或其他等效药物。一旦改善,皮质类固醇激素逐渐减量后可继续使用ICPis。如果使用皮质类固醇激素后情况恶化或未见改善,增加皮质类固醇激素剂量,2 mg/(kg•d)(甲基)泼尼松龙或其他等效药物,并且永久停用ICPis(Ⅳ~Ⅴ,B)。
对于转氨酶或总胆红素水平3/4 级升高的患者,永久停用ICPis,并且使用皮质类固醇激素治疗,初始剂量为1~2 mg/(kg•d)(甲基)泼尼松龙或其他等效药物。如果2~3 天内患者对皮质类固醇激素无反应,应加用吗替麦考酚酯(mycophenolate mofetil,MMF)1000 mg,每天2 次(Ⅳ~Ⅴ,B)。对于皮质类固醇激素和吗替麦考酚酯难治病例,可以请肝脏科医生会诊并考虑肝组织活检(Ⅳ~Ⅴ,B)。
该指南未对三线免疫抑制治疗进行明确定义,但提出1 例Ipilimumab 引起的对激素及吗替麦考酚酯抵抗的肝炎患者应用抗胸腺细胞免疫球蛋白(anti-thymocyte globulin,ATG)治疗成功的病例。另一种三线免疫抑制剂——他克莫司因起效缓慢,并未用于暴发性肝炎患者。同时也有研究指出,激素治疗失败、疾病快速进展、器官功能衰竭是考虑ATG 治疗的主要原因。不同于其他消化道免疫相关不良反应,英夫利西单抗因其本身的肝脏毒性不推荐用于免疫性肝炎的治疗。
在接受适当治疗后,肝炎通常会在4~6 周内痊愈,而对于未治愈的病例,需要重新考虑其他病因,必要时重复初始诊断流程。该指南特别提出,要考虑同时服用其他肝毒性药物(包括草药和非处方药)和巨细胞病毒再激活的可能。同时需要警惕的是,即使转氨酶水平一度降至正常,临床上仍观察到转氨酶水平反弹甚至发生暴发性肝炎的病例。所以肝功能恢复后仍需要关注患者的临床表现和血清学检测结果。
4 免疫相关胃肠道毒性
免疫相关胃肠道毒性是ICPis 治疗中最常见的不良反应之一,主要表现为:腹泻、结肠/ 小肠炎,发生率高达30%~50%,尤其是3~4 级免疫相关胃肠道不良反应是导致ICPis 治疗中断的最常见原因。由于对治疗和患者体力状态影响较大,临床医生需时刻警惕胃肠道不良反应的发生,掌握其诊断、鉴别诊断及治疗原则。
该指南指出:现有数据主要集中于抗CTLA-4 单抗(Ipilimumab),抗PD-1/PD-L1 单抗的胃肠道不良反应相关数据较少。根据现有研究,抗CTLA-4 单抗的胃肠道不良反应发生风险远高于抗PD-1/PD-L1 单抗,并且可发生于治疗过程中的任意时间,甚至治疗结束后数月。而抗PD-1、PD-L1 单抗的胃肠道不良反应发生的中位时间为用药后3 个月。以上两类药物的联合使用会增加胃肠道不良反应的发生风险,并导致发生时间提前。
临床上为了降低治疗风险,保证治疗顺利进行,筛选出发生严重免疫相关胃肠道不良反应的高危人群,有效预防胃肠道不良反应是临床医生首要关注的问题。但遗憾的是,该指南中并未明确指出免疫相关胃肠道不良反应发生风险的预测因子及有效预防手段。仅少部分研究表明:非甾体抗炎药(nonsteroidal antiinflammatory drugs,NSAIDs)可能会提高抗CTLA-4 单抗发生治疗相关肠炎的风险。因此,对于使用抗CTLA-4 单抗治疗的患者,
若合并轻中度疼痛或发热等症状时,可以考虑减少或避免使用NSAIDs,以尽量降低胃肠道不良反应的发生风险,但尚无临床试验支持。
诊断
虽然腹泻、结肠/ 小肠炎、腹痛、呕吐是免疫相关胃肠道不良反应的常见临床表现,但部分患者还可表现为口腔溃疡、肛门病变(肛瘘、脓肿、肛裂)、关节疼痛、内分泌紊乱以及皮肤病变等肠外表现,需要临床医生警惕。
大多数患者病变累及乙状结肠和直肠,上消化道改变罕见,内镜下多表现为黏膜红斑、糜烂、溃疡形成。与抗PD-1/PD-L1 单抗相比,抗CTLA-4 单抗治疗者显微镜下可见结肠黏膜中性粒细胞、嗜酸性粒细胞浸润,弥漫性/ 局灶性片状隐窝脓肿;而抗PD-1/PD-L1 单抗治疗者除了可见固有层扩张、绒毛缩短、中性粒细胞性隐窝脓肿外,还伴有大量淋巴细胞浸润。该指南还指出,
少数抗CTLA-4 单抗引起的小肠结肠炎患者的血清中发现对抗肠道菌群的抗体和抗中性粒细胞胞质抗体,以及粪便中钙卫蛋白水平升高;但抗肠道菌群的抗体和抗中性粒细胞胞质抗体,以及粪便中钙卫蛋白水平与胃肠道不良反应的发生风险不相关。因此,针对免疫相关胃肠道不良反应发生风险的预测因子的研究仍旧任重道远。
治疗
确诊免疫相关胃肠道不良反应后,临床根据腹泻的严重程度(CTCAE v4.0)和持续时间选择治疗方案。除了停用ICPis 外,该指南推荐,在积极补液、纠正水电解质失衡的基础上,1 级腹泻患者可单纯使用止泻药物(洛哌丁醇等)。2 级及以上腹泻患者,糖皮质激素是首选推荐的治疗药物,具体:糖皮质激素静脉治疗3~5 天内有效的患者,可以转为口服激素治疗,并在8~12 周内逐步减量。
3 ~4 级腹泻或糖皮质激素治疗无效者,免疫抑制剂(如英夫利西单抗、维多珠单抗、MMF 等)也是可以选择的方案,并且上述免疫抑制剂的使用不影响ICPis 的疗效。但是,该指南对上述治疗方案的推荐级别仅为Ⅳ~Ⅴ,B。因此,胃肠道不良反应的治疗原则尚需在临床实践中进一步探索。
ICPis 相关的胃肠道不良反应主要以腹泻、小肠结肠炎为主要表现,上消化道反应罕见,目前尚缺乏有效的预测因子和预防手段。随着用药剂量的累积、多种ICPis 的联合使用会提高胃肠道不良反应的发生风险,糖皮质激素是治疗2 级及以上免疫相关胃肠道不良反应的重要有效药物,对于糖皮质激素治疗无效或3~4 级胃肠道不良反应,免疫抑制剂也是可选的治疗方法。
5 免疫相关性肺炎
免疫相关性肺炎的发生率较低,仅为2%~5%。但是其管理较为复杂,因此临床医生需要充分了解其特点。发生率方面,该指南中所引用的文献收集了两家中心的数据,结果显示黑色素瘤和非小细胞肺癌患者的肺炎发生率相似,但也有汇总数据显示,黑色素瘤患者中肺炎的发生率低于非小细胞肺癌和肾细胞癌。不同用药方案的发生率也不尽相同:抗PD-1 单抗或抗PD-L1 单抗高于抗CTLA-4 单抗,联合治疗高于单药治疗。
随着ICPis、化疗及靶向治疗的联用,这一不良反应谱也会出现较大变化,如经Osimertinib 联合Durvalumab(抗PD-L1 单抗)治疗的非小细胞肺癌患者间质性肺病的发生率高达38%。因此,临床医生更加需要提高对免疫相关性肺炎的警惕性,并及时更新最新进展。高危因素的识别能够帮助我们筛选高危患者并进行密切随访,从而早期发现免疫相关性肺炎,避免严重后果。但遗憾的是,除了瘤种和治疗药物,该指南中并未涉及肺炎发生的其他危险因素。
KEYNOTE-001 研究发现,曾有胸部放疗史的患者使用Pembrolizumab 后,较无胸部放疗史者更易出现治疗相关的肺损伤(13% vs. 1%)。其他潜在的危险因素可能有基础肺部疾病、吸烟等,但现阶段尚无数据支持这些假设。
相关检查
尽管咳嗽、呼吸困难等呼吸系统不良事件的发生率高达20%~40%,但免疫相关性肺炎的发生率仅为2%~5%。该指南指出,对于所有新发的呼吸系统症状(上呼吸道感染、咳嗽、喘息、呼吸困难等)均应完善胸部CT 检查;理想情况下,所有≥ 2 级的肺炎均应在使用免疫抑制药物前行气管镜检查来完全排除感染。
但临床实践中,大多数肺炎并不需要行有创的气管镜检查和活检;但由于治疗相关性肺炎的临床表现(主要为呼吸困难、咳嗽、胸痛等)和影像学特点(主要包括磨玻璃样变、原发性机化性肺炎样表现、间质性肺炎、过敏性肺炎等)缺乏特异性,难以同感染或肿瘤进展相鉴别,所以有时肺组织活检是必须的。活检方式可以选择支气管镜下活检(可同时行支气管肺泡灌洗)、CT引导下肺穿刺活检或胸腔镜下/ 开胸肺活检;而究竟选择何种活检方式取决于病灶的位置和分布、胸外科医生的技术水平以及患者个体的危险因素。一旦进行了肺组织活检,则需要向病理科医生充分说明疾病的背景、活检的原因及诊疗经过。
笔者认为,鉴于ICPis 潜在的致命性心脏毒性,对于呼吸困难和存在肺部磨玻璃影的患者也应高度警惕治疗相关心功能不全的可能。确诊免疫相关性肺炎后,需要进一步评估疾病的严重程度。该指南推荐除血常规、肝肾功、电解质、红细胞沉降率及C 反应蛋白这些基础检查外,还推荐对于≥ 2 级的肺炎患者进行肺功能检查(需要包括肺泡弥散功能检查,如一氧化碳弥散量)。笔者建议常规进行血气分析(或指尖氧饱和度监测)。
理想情况下,应综合上述检验和检查结果来判断疾病的严重程度,从而制订合理的治疗方案,但遗憾的是,该指南所推荐的治疗主要依据单一的临床症状:对于仅有影像学改变而缺乏临床症状者(1 级),推荐随访和监测;轻中度症状(2 级)和重度症状/有生命危险者(3~4 级)分别推荐1 mg/(kg•d)和2~4 mg/(kg•d)泼尼松龙治疗(Ⅳ~Ⅴ,B)。
相关治疗
在治疗开始后应密切评估病情:对于2 级肺炎,每2~3 天评估1 次临床症状,最好能同时进行影像学评估;对于3~4 级肺炎,治疗2 天后就应进行临床症状和影像学的评估,若无好转征象,则应尽早加用英夫利西单抗、MMF 或环磷酰胺等免疫抑制剂。
在临床实践中,肿瘤科医生可能会遇到临床症状和影像学表现不相符的情况(如症状轻微但肺间质改变显著,或激素治疗后症状好转但影像学无变化甚至恶化),此类患者激素和其他免疫抑制剂的使用以及剂量均需在多学科诊疗模式下决定,因为目前该指南中推荐意见的级别仅为Ⅳ~Ⅴ级。
在治疗过程中需要特殊强调的是感染和抗生素问题。一方面,对于无法完全排除感染病因的3~4级肺炎,指南推荐在使用激素的同时进行经验性广谱抗感染治疗;另一方面,对于长期使用免疫抑制剂的患者,也应该根据我国现有指南进行卡式肺包虫病的预防。
此外,长期使用激素者,应注意补充维生素D 和钙剂;对食管癌和胃癌等上消化道肿瘤患者,还应警惕激素诱导的上消化道出血可能。这些注意事项在免疫相关性肺炎的处理中可能更为重要,因为治疗肺炎的激素使用量[2~4 mg/(kg•d)] 大于治疗其他不良反应的激素使用量[2 mg/(kg•d)]。
6 罕见的免疫相关毒性
罕见的免疫相关毒性包括神经系统毒性、心脏毒性、风湿免疫毒性、肾毒性等方面。称其为罕见,却仍有1%~12% 的报道率,且更倾向发生于采取联合治疗的患者。罕见并不等同于不重要,其发生后对患者的损害程度可导致短时间的死亡,对其更应加强重视。该指南所涉及的罕见免疫相关毒性,如肾毒性、神经系统毒性、心脏毒性对患者的威胁尤为明显,本文将结合指南及既往文献对其进一步阐述。
肾毒性
该指南指出,肾功能不全较少见于单一免疫治疗患者,但在联合治疗或序贯治疗时其发生率却大大提高。肾炎的发生与目前的免疫疗法有关,且需要免疫抑制治疗。该指南指出,发生严重肾功能不全时应咨询肾内科医生,至于肾活检在辅助诊断中的作用仍需进一步探讨。在使用ICPis期间发生急性肾损伤并行肾活检的患者,最常见的病理特征是伴随淋巴细胞浸润的急性肾小管间质性肾炎。
另外,皮疹的伴随出现也较为常见。该指南指出,在每次使用ICPis 前,都应检测血清钠、钾、肌酐及尿素氮水平,如果肌酐水平升高超过1.5 倍(与治疗前基线值相比)或出现蛋白尿等肾损害,则需要立即咨询肾内科医生,以尽早开始大剂量皮质激素治疗,防止对肾脏的进一步损害。总体来说,在尽早干预肾毒性的情况下,恢复肾脏功能的预后是良好的。一般解决3~4 级肾脏不良反应的时间窗为4.7 周(3~6 周)。
神经系统毒性
该指南指出,免疫治疗对神经系统不良反应发生率目前报道尚不完全一致,但因其具有危及生命的风险,注意潜在的症状至关重要。除了头痛、头晕、共济失调、震颤、冷漠、麻痹、肌阵挛、认知障碍、言语障碍,甚至癫痫都有可能发生,其包括了一系列的神经系统事件,如多神经病、面神经麻痹、脱髓鞘、重症肌无力、格林-巴利综合征、可逆性后部白质脑病、横贯性脊髓炎、肠神经病、脑炎、无菌性脑膜炎。
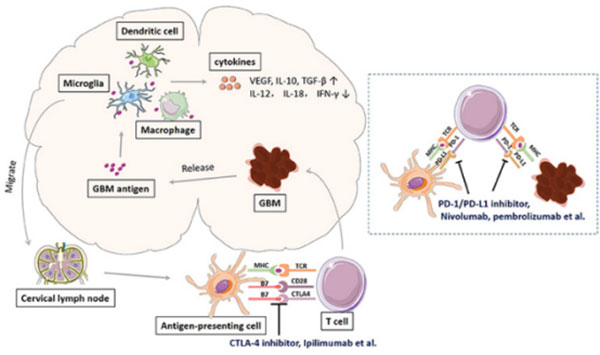
该指南指出除了轻度(1 级)神经系统症状,均应首先停止ICPis治疗,然后根据症状考虑使用泼尼松龙或大剂量甾体类药物治疗。此外,血浆置换或静脉注射免疫球蛋白可用于肌无力和格林- 巴利综合征。另外,该指南要求排除由于潜在肿瘤进展、癫痫发作、感染及代谢紊乱导致的神经系统损害,但如何准确并及时地排除,指南并未详细描述。目前来说,所有的参与治疗医生、患者及其家属都应意识到潜在的神经系统不良反应可能发生于治疗时或治疗结束后的任何时期,从而尽量避免神经系统毒性导致的死亡。
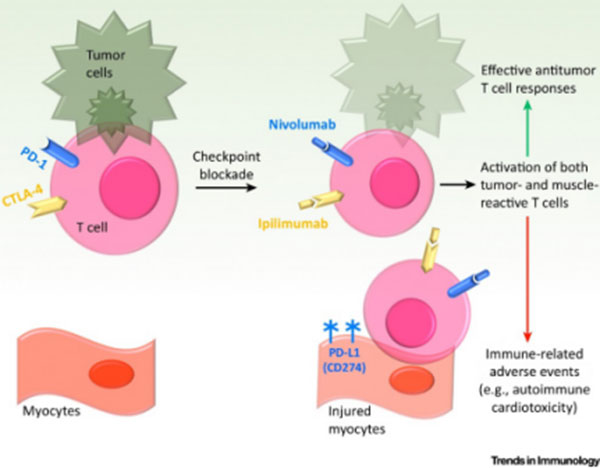
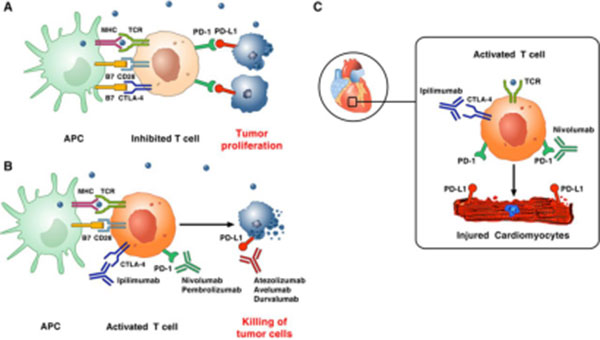
心脏毒性
该指南指出,心脏不良反应的发生率低,但表现形式多样,包括心肌炎、心包炎、心律失常、心肌病及心室功能损害,常见的临床表现为呼吸困难、疲劳、外周水肿、双侧啰音、胸痛、心律失常、晕厥等。然而,目前还没有建立与免疫抑制剂相关的心血管评估、诊断或监测标准来指导临床实践。若患者出现血流动力学不稳定,需要强调对症状的早期识别,以确保患者转移至重症监护室进行血流动力学监测和支持,但该指南并未描述如何进行早期识别。
早期诊断包括冠状动脉造影、心功能显像及包括心肌肌钙蛋白和N 端B 型利钠肽原(NT-proBNP)在内的生物标志物。超声心动图通常作为确定左室功能不全程度的首选方法,心脏磁共振与组织特征对怀疑为心肌炎的患者提供了宝贵的资料。对血流动力学不稳定的患者,应早期进行右心导管法心内膜心肌活检,其为自身免疫性心肌炎诊断的金标准。
活检可显示心肌内有明显的片状淋巴细胞浸润,常累及房室结和心脏窦,伴或不伴纤维化。免疫组化染色可通过CD3+、CD4+、CD8+ T 细胞的存在进行诊断,另外可以考虑如CD68 巨噬细胞标记和Foxp3 调节性T 细胞凋亡标记。活检标本的PCR 分析有助于排除病毒性心肌炎。
如患者高度怀疑为药物引起的心脏不良反应,血流动力学不稳定患者的初始治疗包括呼吸和血流动力学支持;在血流动力学稳定的患者中,应考虑治疗心力衰竭。对于出现心律失常和传导延迟的患者,应采用低阈值插入静脉起搏器,因其进展至完全性心脏传导阻滞的风险似乎很高。该指南指出,大剂量皮质类固醇激素可以有效治疗心脏不良反应,当怀疑为免疫检查点抑制剂诱发的心脏不良反应时,应尽快使用。如使用甾体类药物后症状未能迅速缓解,必要时可加用其他免疫抑制药物,如英夫利西单抗、MMF 及ATG。因心脏不良反应发生的数量逐渐增加,且对患者的风险较高,目前亟需建立相关的心血管评估、诊断及有效治疗体系。
结语
免疫治疗是肿瘤治疗的里程碑,ICPis 是目前免疫治疗的主要方式。随着临床经验的不断积累,肿瘤科医生对于免疫相关不良反应已有一定的认识。2017 年,ESMO 终于以指南的形式对这些不良反应进行了详细的梳理和具体的管理流程推荐,这对于临床实践的规范化和系统化具有极为重要的意义。然而,这些推荐意见的证据级别较低,仍需更多前瞻性的临床数据来优化治疗流程。此外,也应关注不良反应的预测以及不同危险分层患者的随访和预防策略。
(转载自《肿瘤综合治疗电子杂志》2018年第4卷第1期》)














