2019年上市抗癌药全盘点
近日,美国FDA药物评估和研究中心发布了2019年度报告,报告显示,在2019年,共计有48款新药(包括新分子实体和新生物制品)获得FDA批准上市,相比2018年的59款略有下降,相对应的欧盟药品管理局则在2019年共批准了37款创新药(包括新活性物质,不包括仿制药、生物类似物),低于2018年的64款,而我国国家药品监督管理局则在2019年共批准了58款创新药(包括化药1类和5.1类,生物制品1类和2类、中药和疫苗)上市,高于2018年的48款,涵盖癌症、罕见病、抗病毒感染如丙肝、流感,免疫类、神经系统、泌尿系统、皮肤病等多个治疗领域,其中,抗癌药成为最大赢家,共计12款抗癌药物在2019年首次获得批准上市。

肺癌EGFR突变新药
药品名称:达可替尼(商品名:多泽润)
研发药企:辉瑞
获批时间:2019年5月15日
获批适应证:单药用于表皮生长因子受体19号外显子缺失突变或21号外显子L858R置换突变的局部晚期或转移性非小细胞肺癌一线
达可替尼是一种口服、选择性、三磷腺苷(ATP)竞争性、不可逆性的人表皮生长因子受体(HER,erbB)家族受体酪氨酸激酶的小分子抑制剂,通过抑制EGFR家族的酪氨酸激酶活性,发挥抗肿瘤作用,其在中国EGFR突变患者临床试验的中位PFS达到18.4个月。中位OS可提高半年多(34.1个月 vs 26.8个月),一线使用达可替尼平均总生存已经接近3年。
目前,该药在美国、欧盟、日本、加拿大等均已获批用于一线治疗,同时,达可替尼获批在中国首次实现几乎与美国、欧洲、日本等国家和地区的全球同步递交并获得监管部门的批准。
首个骨巨细胞瘤治疗药物
药品名称:地舒单抗(商品名:安加维)
研发药企:安进
获批时间:2019年5月22日
获批适应证:用于骨巨细胞瘤不可手术切除或者手术切除可能导致严重功能障碍的成人和骨骼发育成熟的青少年患者治疗
地舒单抗是一种新型RANKL抑制剂,是RANKL的全人化单克隆IgG2抗体,对可溶性、跨膜形式的人RANKL具有高度亲和力和特异性,在骨巨细胞瘤患者中,地舒单抗对肿瘤基质成分所分泌的RANKL的抑制可显著减少或消除破骨细胞样肿瘤相关巨细胞,因此,骨质溶解减少,巨细胞肿瘤进展减慢,增生性基质被致密的非增生性、分化型编织新骨代替,从而改善临床结局。
地舒单抗的一项关键性临床试验Study 20040215显示,在可以手术切除的患者中,80%的患者接受新辅助地舒单抗治疗后得到改善:44%接受了对功能影响较小的手术,37%避免了手术。在无法手术切除的患者中,地舒单抗带来了有效的长期疾病控制,5年PFS率为88%。
第三个国产PD-1单抗
药品名称:卡瑞利珠单抗(商品名:艾立妥)
研发药企:恒瑞医药
获批时间:2019年5月31日
获批适应证:用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤患者的治疗
卡瑞利珠单抗为我国获批上市的第三个国产PD-1单抗药物,在一项75例18岁以上的自体造血干细胞移植后或≥2线全身化疗、不适合进行造血干细胞移植的复发或难治性cHL患者的临床试验结果显示,其客观有效率达到84.8%,完全缓解率(CR)达到30.3%,研究期间可观察到患者靶病灶肿瘤负荷明显减少,研究者评价的ORR和CR率分别为80.3%和36.4%。
目前,卡瑞利珠单抗目前还在开展其他多项适应证的临床试验研究,包括晚期非小细胞肺癌(NSCLC)、纵膈原发弥漫大B细胞淋巴瘤、胃食管癌。
首个单抗类多发性骨髓瘤新药
药品名称:达雷妥尤单抗(商品名:兆珂 )
研发药企:西安杨森
获批时间:2019年7月5日
适应证:用于单药治疗复发和难治性多发性骨髓瘤成年患者,包括既往接受过一种蛋白酶体抑制剂和一种免疫调节剂且最后一次治疗时出现疾病进展的患者治疗
达雷妥尤单抗是一种人源化、抗CD38 IgG1单克隆抗体,与肿瘤细胞表达的CD38结合,通过补体依赖的细胞毒作用(CDC)、抗体依赖性细胞介导的细胞毒作用(ADCC)和抗体依赖性细胞吞噬作用(ADCP)、以及Fcγ受体等多种免疫相关机制诱导肿瘤细胞凋亡。
达雷妥尤单抗是国内首个获批的靶向作用于CD38的全人源单克隆抗体,其一方面可直接与CD38结合,通过多重机制诱导骨髓瘤细胞死亡,达到快速缓解;另一方面通过调节免疫微环境,激活免疫细胞CD8+毒性T细胞、CD4+辅助T细胞,持续促进骨髓瘤细胞死亡。
据两项国际临床研究汇总分析结果显示,既往接受过多线治疗的多发性骨髓瘤患者使用16mg/kg达雷妥尤单抗单药治疗,中位总生存期延长至20个月,总缓解率为31%。
独特的晚期乳腺癌药物
药品名称:甲磺酸艾立布林(商品名:海乐卫)
研发药企:卫材
获批时间:2019年7月15日
获批适应证:用于治疗既往接受过至少两种化疗方案(包括蒽环类和紫杉类)治疗的局部复发或转移性乳腺癌患者
艾立布林是一种软海绵素类微管动力学抑制剂,具有独特的结合特性。除了传统的作用机制外,体外研究显示了艾立布林对肿瘤微环境的独特作用,例如:增加肿瘤核心的血管灌注和通透性,促进上皮状态,降低乳腺癌细胞的迁移能力等。
目前,艾立布林已在包括欧洲、美洲和亚洲在内的65个国家和地区获得批准,用于乳腺癌的治疗。
一项Ⅲ期临床研究显示,与长春瑞滨对照治疗组相比,艾立布林治疗组的主要终点,即无进展生存期(PFS)实现了统计学显著的延长。
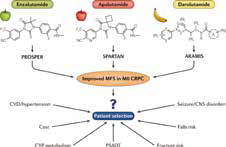
首个新一代雄激素受体抑制剂获批治疗前列腺癌患者
药品名称:阿帕他胺(商品名:安森珂)
研发药企:强生
获批时间:2019年9月6日
获批适应证:用于治疗有高危转移风险的非转移性去势抵抗性前列腺癌(NM-CRPC)成年患者
阿帕他胺是中国首个获批用于NM-CRP患者的新一代雄激素受体抑制剂。它可阻断前列腺癌细胞中的雄激素信号通路,通过三种途径抑制癌细胞的生长:抑制雄激素与雄激素受体(AR)的结合,抑制活化AR的核转运,以及抑制AR与癌细胞的脱氧核糖核酸(DNA)结合从而阻断AR介导的转录。
临床研究显示,阿帕他胺对前列腺癌患者早期治疗和预后的重要指标--前列腺特异性抗原(PSA)水平有着显著的控制作用。
又一个前列腺癌重磅新药
药品名称:恩扎卢胺(商品名:安可坦)
研发药企:安斯泰来
获批时间:2019年11月18日
获批适应证:用于雄激素剥夺治疗失败后无症状或有轻微症状且未接受化疗的转移性去势抵抗性前列腺癌成年患者的治疗
恩扎卢胺是一种雄激素受体信号传导抑制剂,可直接靶向雄激素受体(AR),并在AR信号传导途经的抑制雄激素结合、抑制雄激素结合、削弱DNA结合等三个步骤中发挥作用。恩杂鲁胺是FDA批准的第一个既用于转移性又用于非转移性去势抵抗前列腺癌的口服药物。
国内首款自主研发的白血病新药
药品名称:甲磺酸氟马替尼(商品名:豪森昕福)
研发药企:豪森药业
获批时间:2019年11月26日
获批适应证:用于治疗费城染色体阳性的慢性髓性白血病(Ph+ CML)慢性期成人患者
甲磺酸氟马替尼是中国首个自主研发的新型二代BCR-ABL酪氨酸激酶抑制剂(TKI),从结构上看,氟马替尼是在伊马替尼分子结构基础上进行优化设计和修饰,独特机制赋予其强效、高选择性,可以认为是升级版的格列卫。
临床前研究结果表明,氟马替尼抑制野生型及常见突变作用更强,且对伊马替尼耐药的ABL激酶选择性优于常用TKI,“脱靶”现象更少。

国内首个PD-L1单抗
药品名称:度伐利尤单抗注射液(商品名:英飞凡)
研发药企:阿斯利康
获批时间:2019年12月9日
获批适应证:用于治疗同步放化疗后未进展的不可切除Ⅲ期非小细胞肺癌
度伐利尤单抗是中国首个获批上市的PD-L1单抗药物,其靶向细胞程序性死亡因子配体1(PD-L1),能直接结合PD-L1蛋白,并抑制它与T细胞表面的PD-1蛋白和CD80的结合,肿瘤细胞就无法利用PD-L1/PD-1途径来逃避免疫系统的追杀,Imfinzi也正是利用这一机理,起到激活免疫系统,进而杀伤肿瘤的效果。
已经在包含美国在内的全球11个国家和地区被批准用于经治晚期膀胱癌患者的治疗。目前,Imfinzi还以研发代号为MEDI4736在药物临床试验登记与信息平台共登记了9项临床试验,包括针对非小细胞肺癌、局限期小细胞肺癌、尿路上皮癌、肝细胞癌等适应证的多项研究正在进展中。
同靶点药物方面,罗氏子公司基因泰克公司研发的阿特珠单抗(Tecentriq)简称“T药”,进入中国市场的上市申请已于2019年2月获得承办,受理号为JXSS1900004,有望今年获批。

黑色素瘤双靶向联合治疗药物
药品名称:达拉非尼(泰菲乐)+曲美替尼(迈吉宁)
研发药企:诺华
获批时间:2019年12年19日
获批适应证:用于治疗BRAF V600突变阳性的不可切除或转移性黑色素瘤治疗
达拉非尼是一种强效和选择性BRAF激酶活性抑制剂,曲美替尼是一种可逆的、高选择性MEK1和MEK2激酶活性的变构抑制剂。两者联合治疗,针对BRAF V600突变阳性黑色素瘤的驱动突变靶点,可以使病灶得到快速且显著的缓解,并改善患者的无进展生存。
多项全球关键性临床研究结果显示,对比靶向单药治疗,泰菲乐联合迈吉宁可帮助BRAF V600突变黑色素瘤患者,得到更高的疾病缓解,实现更长的无进展生存。

首个本土卵巢癌创新药
药品名称:尼拉帕利(商品名:则乐)
研发药企:再鼎医药
获批时间:2019年12月27日
获批适应证:用于含铂化疗完全或部分缓解的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者维持治疗
尼拉帕利是全球第三个上市的PARP抑制剂产品,也是全球第一个获批的适用于所有铂敏感复发卵巢癌患者群体、而无论BRCA是否突变的PARP抑制剂,一项Ⅲ期临床试验显示,不管患者是否存在胚系BRCA突变,尼拉帕利都能不同程度延长卵巢癌患者中位无进展生存期(PFS),帮助延缓复发、延长患者生存,提高生活质量。
临床研究显示,与安慰剂组相比,在gBRCA突变患者中,疾病进展风险下降73%,PFS延长至4倍(21个月对比5.5个月);在无gBRCA突变组患者中,疾病进展风险降低了55%,PFS延长2倍以上。
目前尼拉帕利尚未获批用于晚期卵巢癌一线维持治疗,再鼎医药计划即将向国家药监局提交尼拉帕利作为对铂类应答的卵巢癌患者一线单药维持治疗的补充新药申请。

第四个国产PD-1单抗
药品名称:替雷利珠单抗注射液(商品名:百泽安)
研发药企:百济神州
获批时间:2019年12月27日
获批适应证:替雷利珠单抗是一款在研人源性IgG4抗PD-1单克隆抗体,临床前数据显示,抗体药物在与巨噬细胞表面Fc受体结合后,会激活抗体依赖性巨噬细胞介导杀伤T细胞,阻止了T细胞杀伤肿瘤细胞的能力,这个效应对免疫治疗作用有害。
为了解决这一问题,替雷利珠单抗特别对药物结构中恒定区域进行了改造,去除了与Fc受体结合的能力,最大限度上减少了与具有Fc受体的巨噬细胞的结合,使巨噬细胞不再攻击T细胞,消除或减少免疫治疗效果的不利影响。这也是替雷利珠单抗不同于其他抗体的,而与人PD-1受体结合并阻断PD-1/PD-L1通路、恢复机体抗肿瘤免疫力的机制与其他PD-1抗体类似。
近日,百济神州宣布其公司旗下PD-1药物百泽安(通用名:替雷利珠单抗注射液,Tislelizumab, BGB- A317)已获得国家药品监督管理局(NMPA)批准,用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤(R/R cHL)患者。这也是目前国内市场获批上市的第六款、国产第四款PD-1单抗药物。
(来源 医谷)


